Скандий Sc
Скандий в таблице менделеева занимает 21 место, в 4 периоде.| Символ | Sc |
| Номер | 21 |
| Атомный вес | 44.9559080 |
| Латинское название | Scandium |
| Русское название | Скандий |
Электронная схема скандия
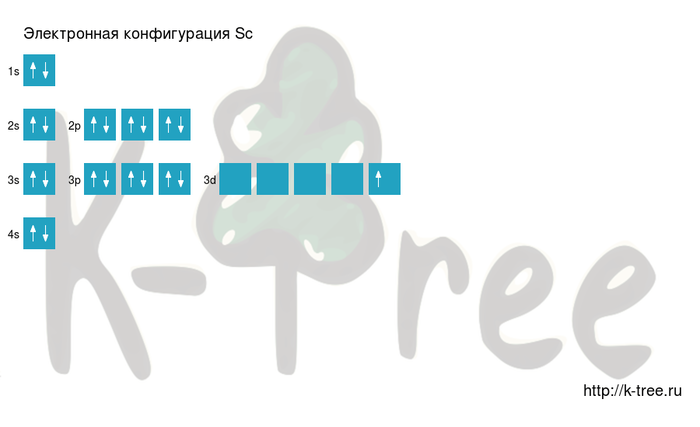
Sc: 1s2 2s2 2p6 3s2 3p6 4s2 3d1
Короткая запись:
Sc: [Ar]4s2 3d1
Одинаковую электронную конфигурацию имеют атом скандия и V+2, Mn+4, Fe+5
Порядок заполнения электронами оболочек атома скандия (Sc): 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘p’ - до 6, на ‘d’ - до 10 и на ‘f’ до 14
Скандий имеет 21 электрон, заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
6 электронов на 3p-подуровне
2 электрона на 4s-подуровне
1 электрон на 3d-подуровне
Степень окисления скандия
Атомы скандия в соединениях имеют степени окисления 3, 2, 1.
Степень окисления - это условный заряд атома в соединении: связь в молекуле между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается, то степень окисления положительная.
Ионы скандия
Валентность Sc
Атомы скандия в соединениях проявляют валентность III, II, I.
Валентность скандия характеризует способность атома Sc к образованию химических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Sc
Квантовые числа определяются последним электроном в конфигурации, для атом Sc эти числа имеют значение N = 3, L = 2, Ml = -2, Ms = +½
Видео заполнения электронной конфигурации (gif):
Результат:
Энергия ионизации
Чем ближе электрон к центру атома - тем больше энергии необходимо, что бы его оторвать. Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo. Если не указано иное, то энергия ионизации - это энергия отрыва первого электрона, также существуют энергии ионизации для каждого последующего электрона.
Энергия ионизации Sc:
Eo = 633 кДж/моль
Перейти к другим элементам таблицы менделеева
Где Sc в таблице менделеева?Таблица Менделеева
Скачать таблицу менделеева в хорошем качестве
