Азот N
Азот в таблице менделеева занимает 7 место, в 2 периоде.| Символ | N |
| Номер | 7 |
| Атомный вес | 14.0064300 |
| Латинское название | Nitrogenium |
| Русское название | Азот |
Электронная схема азота
N: 1s2 2s2 2p3
Короткая запись:
N: [He]2s2 2p3
Одинаковую электронную конфигурацию имеют атом азота и C-1, O+1
Порядок заполнения электронами оболочек атома азота (N): 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘p’ - до 6, на ‘d’ - до 10 и на ‘f’ до 14
Азот имеет 7 электронов, заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
3 электрона на 2p-подуровне
Степень окисления азота
Атомы азота в соединениях имеют степени окисления 5, 4, 3, 2, 1, 0, -1, -2, -3.
Степень окисления - это условный заряд атома в соединении: связь в молекуле между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается, то степень окисления положительная.
Ионы азота
Валентность N
Атомы азота в соединениях проявляют валентность V, IV, III, II, I.
Валентность азота характеризует способность атома N к образованию химических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа N
Квантовые числа определяются последним электроном в конфигурации, для атом N эти числа имеют значение N = 2, L = 1, Ml = 1, Ms = +½
Видео заполнения электронной конфигурации (gif):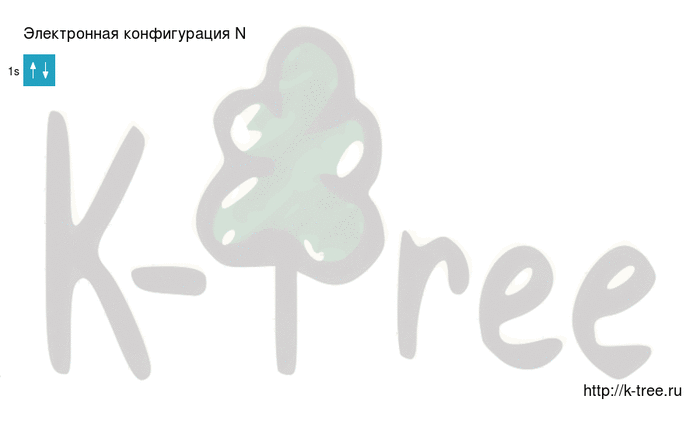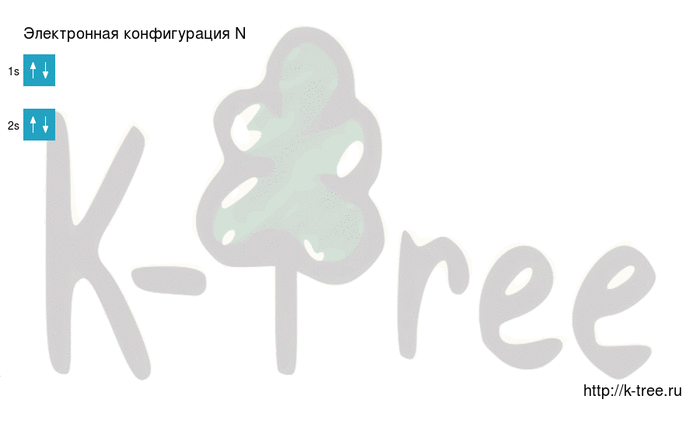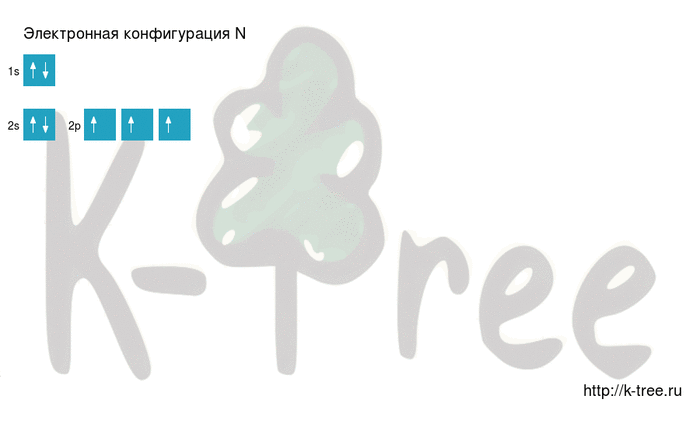
Результат:

Соединения азота
| Тип | Формула | Название |
|---|---|---|
| Кислота | HNO3 | Азотная кислота |
| HNO2 | Азотистая кислота | |
| Основание | NH3 | Аммиак |
| Оксид | N2O | Оксид азота (I) |
| NO | Монооксид азота | |
| N2O3 | Азотистый ангидрид | |
| NO2 | Диоксид азота | |
| N2O5 | Азотный ангидрид |
Энергия ионизации
Чем ближе электрон к центру атома - тем больше энергии необходимо, что бы его оторвать. Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo. Если не указано иное, то энергия ионизации - это энергия отрыва первого электрона, также существуют энергии ионизации для каждого последующего электрона.
Энергия ионизации N:
Eo = 1402 кДж/моль
Перейти к другим элементам таблицы менделеева
Где N в таблице менделеева?Таблица Менделеева
Скачать таблицу менделеева в хорошем качестве
